Графитът, молекулна формула: C, молекулно тегло: 12,01, е форма на елемент въглерод, всеки въглероден атом е свързан с три други въглеродни атома (подредени в шестоъгълници тип пчелна пита), за да образуват ковалентна молекула. Тъй като всеки въглероден атом излъчва електрон, тези, които могат да се движат свободно, така че графитът е проводник.
Графитът е един от най-меките минерали и неговите употреби включват направата на моливи и лубриканти. Въглеродът е неметален елемент, разположен във втория цикъл IVA група на периодичната таблица. Графитът се образува при високи температури.
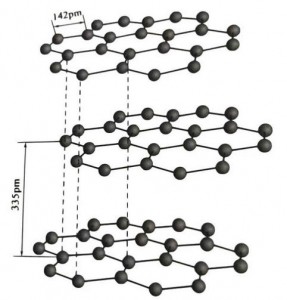
Графитът е кристален минерал от въглеродни елементи и неговата кристална решетка е шестоъгълна слоеста структура. Разстоянието между всеки мрежест слой е 3.35A, а разстоянието на въглеродните атоми в същия мрежест слой е 1.42A. Това е шестоъгълна кристална система с пълно слоесто разцепване. Повърхността на разцепване е главно молекулярни връзки, по-малко привлекателни за молекулите, така че нейната естествена плувка е много добра.
В графитните кристали въглеродните атоми в един и същи слой образуват ковалентна връзка с sp2 хибридизация и всеки въглероден атом е свързан с три други атома в три ковалентни връзки. Шестте въглеродни атома образуват шест непрекъснат пръстен в една и съща равнина, разширявайки се в ламелна структура, където дължината на връзката на CC връзката е 142pm, което е точно в диапазона на дължината на връзката на атомния кристал, така че за същия слой , това е атомен кристал. Въглеродните атоми в една и съща равнина имат една p орбита, която се припокрива. Електроните са относително свободни, еквивалентни на свободните електрони в металите, така че графитът може да провежда топлина и електричество, което е характеристиката на металните кристали. По този начин също се класифицират като метални кристали.
Средният слой от графитен кристал е разделен от 335pm и разстоянието е голямо. Комбинира се със силата на Ван дер Ваалс, тоест слоят принадлежи към молекулярния кристал. Въпреки това, тъй като свързването на въглеродните атоми в един и същи плосък слой е много силно и изключително трудно за разрушаване, точката на разтваряне на графита също е много висока и неговите химични свойства са стабилни.
С оглед на неговия специален режим на свързване, графитът не може да се разглежда като монокристал или поликристал, сега обикновено се разглежда като смесен кристал.
Време на публикуване: 31 юли 2023 г